Dusičnan amonno-ceričitý
| Dusičnan amonno-ceričitý | |
|---|---|
 Vzorek dusičnanu amonno-ceričitého | |
| Obecné | |
| Systematický název | dusičnan amonno-ceričitý |
| Funkční vzorec | (NH4)2[Ce(NO3)6] |
| Sumární vzorec | N8H8CeO18 |
| Vzhled | oranžovočervený prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 16774-21-3 |
| EC-no (EINECS/ELINCS/NLP) | 240-827-6 |
| PubChem | 180504 |
| SMILES | [Ce+4].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[NH4+].[NH4+] |
| InChI | InChI=1S/Ce.6NO3.2H3N/c;6*2-1(3)4;;/h;;;;;;;2*1H3/q+4;6*-1;;/p+2 |
| Vlastnosti | |
| Molární hmotnost | 548,22 g/mol |
| Teplota tání | 108 °C (381,0 K) |
| Rozpustnost ve vodě | 141 g/100 ml (25 °C) 227 g/100 ml (80 °C) |
| Bezpečnost | |
 GHS03  GHS05  GHS07 | |
| H-věty | H272 H302 H315 H318 H319 H335[1] |
| P-věty | P210 P220 P261 P264+265 P270 P271 P280 P301+317 P302+352 P304+340 P305+351+338 P305+354+338 P317 P319 P321 P330 P332+317 P337+317 P362+364 P370+378 P403+233 P405 P501[1] |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Dusičnan amonno-ceričitý je anorganická sloučenina se vzorcem (NH4)2[Ce(NO3)6]. Používá se jako oxidační činidlo v organické syntéze a jako standard v kvantitativní analýze.
Příprava a vlastnosti
Anion [Ce(NO3)6]2− vzniká rozpouštěním oxidu ceritého (Ce2O3) v horké koncentrované kyselině dusičné (HNO3).
Sůl se skládá z hexanitratoceričitanového aniontu, [Ce(NO3)6]2−, a dvou amonných kationtů, NH +
4 ; amonné ionty se oxidačních reakcí této soli neúčastní. Každá dusičnanová skupina je navázána na atom ceru jako bidentátní ligand:
-
 Strukturní vzorec hexanitrato-
Strukturní vzorec hexanitrato-
ceričitanového aniontu -
 Model hexanitrato-
Model hexanitrato-
ceričitanového aniontu<ref>{{Citace periodika
Anion [Ce(NO3)6]2− vykazuje molekulovou symetrii typu Th. CeO12 jádra mají tvar dvacetistěnu.[2]
Ceričité ionty (Ce4+) jsou silnými oxidačními činidly, jejich redoxní potenciál (E° ~ 1,61 V) je vyšší než u chloru (Cl) (E° ~ 1,36 V) a pouze několik málo stálých látek má silnější oxidační účinky. Při redukci Ce4+ na Ce3+ dochází ke změně barvy roztoku z oranžové na světle žlutou.
Použití
V organické syntéze lze dusičnan amonno-ceričitý použít k oxidacím řady funkčních skupin (alkoholů, fenolů a etherů) a vazeb C–H, obzvláště benzylových. Alkeny bývají dinitroxylovány, přesný výsledek reakce ale závisí na použitém rozpouštědle. Z katecholů a hydrochinonů lze připravit chinony, zoxidovat se dají též nitroalkany.[3][4]
Použití dusičnanu amonno-ceričitého je alternativou Nefovy reakce, například při syntéze ketomakrolidu, kde se v případě použití jiných činidel často objevují vedlejší reakce. Oxidační bromaci benzylových skupin lze provést pomocí dusičnanu amonno-ceričitého jako oxidantu; podobně je možné jodovat ketony a deriváty uracilu.
Příprava heterocyklických sloučenin
Katalytická množství (NH4)2[Ce(NO3)6] ve vodných roztocích mohou být použita na přípravu chinoxalinů. Chinoxaliny se dají použít jako barviva, organické polovodiče, a na štěpení DNA; také jsou součástí struktury některých antibiotik, například echinomycinu a aktinomycinu. Třísložkové reakce anilinů s alkylvinylethery katalyzované touto látkou mohou být použity na tvorbu 2-methyl-1,2,3,4-tetrahydrochinolinů a příslušných chinolinů jejich aromatizací.
Odstraňování chránicích skupin
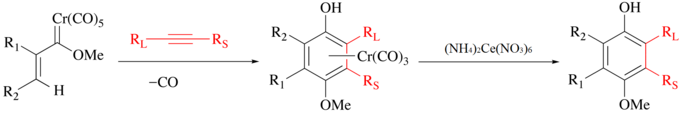
Dusičnan amonno-ceričitý se používá na odstraňování organických ligandů z karbonylových komplexů. Při těchto reakcích dochází k oxidaci kovu a uvolnění CO a organického ligandu, který může být dále použit.[5] Jako příklad může sloužit Wulffova–Dötzova reakce alkynu, oxidu uhelnatého a karbenu chromu za vzniku polosendvičového komplexu[6][7] a izolace fenolového ligandu po oxidaci dusičnanem amonno-ceričitým.
(NH4)2[Ce(NO3)6] může také štěpit para-methoxybenzyl- a 3,4-dimethoxybenzylethery, používané jako chránicí skupiny na alkoholech.[8][9] Na každý ekvivalent para-methoxybenzyletheru jsou třeba dva ekvivalenty (NH4)2[Ce(NO3)6]. Po oddělení alkoholu se para-methoxybenzylether mění na para-methoxybenzaldehyd:
- 2 [NH4]2[Ce(NO3)6] + H3COC6H4CH2OR + H2O → 4 NH +
4 + 2 Ce3+ + 12 NO −
3 + 2 H+ + H3COC6H4CHO + HOR
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Ceric ammonium nitrate na anglické Wikipedii.
- ↑ a b c d https://pubchem.ncbi.nlm.nih.gov/compound/180504
- ↑ Thomas A. Beineke; J. Delgaudio. Crystal structure of ceric ammonium nitrate. Inorganic Chemistry. 1968, s. 715–721. DOI 10.1021/ic50062a020.
- ↑ Vijay Nair; Ani Deepthi. Cerium(IV) Ammonium Nitrate - A Versatile Single-Electron Oxidant. Chemical Reviews. 2007, s. 1862–1891. DOI 10.1021/cr068408n. PMID 17432919.
- ↑ Vellaisamy Sridharan; J. Carlos Menéndez. Cerium(IV) Ammonium Nitrate as a Catalyst in Organic Synthesis. Chemical Reviews. 2010, s. 3805–3849. DOI 10.1021/cr100004p. PMID 20359233.
- ↑ L. Brener, J. S. McKennis, R. Pettit Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione Organic Syntheses 1976, 55, 43 DOI:10.15227/orgsyn.055.0043Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ M. Waters; W. D. Wulff. The Synthesis of Phenols and Quinones via Fischer Carbene Complexes. Organic Reactions. 2008, s. 121–623. DOI 10.1002/0471264180.or070.02.
- ↑ K. H. Dötz. Carbon-Carbon Bond Formation via Carbonyl-Carbene Complexes. Pure and Applied Chemistry. 1983, s. 1689–1706. DOI 10.1351/pac198355111689.
- ↑ Boons, Geert-Jan.; Hale, Karl J. (2000). Organic Synthesis with Carbohydrates (1st ed.) Sheffield, England: Sheffield Academic Press. pp.33
- ↑ Kocienski, Phillip J. (1994). Protecting Groups Stuttgart, New York Georg Thieme Verlag. pp 8-9, 52-54
Externí odkazy
 Obrázky, zvuky či videa k tématu Dusičnan amonno-ceričitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dusičnan amonno-ceričitý na Wikimedia Commons - Dusičnan amonno-ceričitý na organic-chemistry.org
| Anorganické soli amonné | |
|---|---|
| Halogenidy a pseudohalogenidy | Fluorid amonný (NH4F) • Hydrogendifluorid amonný (NH4HF2) • Bromid amonný (NH4Br) • Chlorid amonný (NH4Cl) • Jodid amonný (NH4I) • Kyanid amonný (NH4CN) • Thiokyanatan amonný (NH4SCN) |
| Soli kyslíkatých kyselin (neuvedeny soli | Chlorečnan amonný (NH4ClO3) • Chloristan amonný (NH4ClO4) • Jodičnan amonný (NH4IO3) • Orthojodistan amonný ((NH4)5IO6) • Siřičitan amonný ((NH4)2SO3) • Hydrogensiřičitan amonný ((NH4)HSO3) • Síran amonný ((NH4)2SO4) • Hydrogensíran amonný ((NH4)HSO4) • Peroxodisíran amonný ((NH4)2S2O8) • Hydrogenseleničitan amonný ((NH4)HSeO3) • Seleničitan amonný ((NH4)2SeO3) • Hydrogenselenan amonný ((NH4)HSeO4) • Selenan amonný ((NH4)2SeO4) • Telluričitan amonný ((NH4)2TeO3) • Telluran amonný ((NH4)2TeO4) • Dusitan amonný (NH4NO2) • Dusičnan amonný (NH4NO3) • Fosfornan amonný (NH4PO2H2) • Hydrogenfosforitan amonný ((NH4)2PO3H) • Dihydrogenfosforečnan amonný (NH4H2PO4) • Hydrogenfosforečnan amonný ((NH4)2HPO4) • Fosforečnan amonný ((NH4)3PO4) • Arseničnan amonný ((NH4)3AsO4) • Hydrogenuhličitan amonný ((NH4)HCO3) • Uhličitan amonný ((NH4)2CO3) • Šťavelan amonný ((NH4)2(CO2)2) • Hydrogenšťavelan amonný ((NH4)H(CO2)2) • Tetraboritan amonný ((NH4)2B2O7) • Manganistan amonný (NH4MnO4) • Technecistan amonný (NH4TcO4) • Rhenistan amonný (NH4ReO4) • Chroman amonný ((NH4)2CrO4) • Dichroman amonný ((NH4)2Cr2O7) • Orthomolybdenan amonný ((NH4)2MoO4) • Heptamolybdenan amonný ((NH4)6Mo7O24•4H2O) • Parawolframan amonný ((NH4)10[H2W12O42]•4H2O) • Metavanadičnan amonný (NH4VO3) • Orthovanadičnan amonný ((NH4)3VO4) • Hexavanadičnan amonný ((NH4)2V6O16) • Diuranan amonný ((NH4)2U2O7) |
| Soli tvořené záměnou vodíku ze sloučenin typu prvekx – vodíky | Hydroxid amonný (NH4OH) • Hydrogensulfid amonný (NH4SH) • Sulfid amonný ((NH4)2S) • Azid amonný (NH4N3) |
| Jiné | |
| Anorganické soli ceričité | |
|---|---|
| Halogenidy a pseudohalogenidy | |
| Soli kyslíkatých kyselin (neuvedeny soli | Chlorečnan ceričitý (Ce(ClO3)4) • Chloristan ceričitý (Ce(ClO4)4) • Bromičnan ceričitý (Ce(BrO3)4) • Jodičnan ceričitý (Ce(IO3)4) • Orthojodistan ceričitý (Ce5(IO6)4) • Metajodistan ceričitý (Ce6I4O23)opravit vzorec • Siřičitan ceričitý (Ce(SO3)2) • Síran ceričitý (Ce(SO4)2) • Dithionan ceričitý (Ce(S2O3)2) • Seleničitan ceričitý (Ce(SeO3)2) • Selenan ceričitý (Ce(SeO4)2) • Dusičnan ceričitý (Ce(NO3)4) • Fosforečnan ceričitý (Ce3(PO4)4) • Hydrogenfosforečnan ceričitý (Ce(HPO4)2) • Metafosforečnan ceričitý (Ce(PO3)4) • Hydrogendifosforečnan ceričitý (Ce3(HP2O7)4) • Uhličitan ceričitý (Ce(CO3)2) • Wolframan ceričitý (Ce(WO4)2) • Vanadičnan ceričitý (Ce3(VO4)4) • Orthoboritan ceritý (Ce3(BO3)4) |
| Soli tvořené záměnou vodíku ze sloučenin typu prvekx – vodíky | |