Trimetilarsina
 | ||
 | ||
| Nombre IUPAC | ||
| Trimetilarsina | ||
| General | ||
| Otros nombres | Trimetilarsano | |
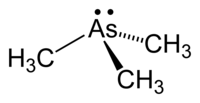
| Fórmula estructural | (CH3)3As | |
| Fórmula molecular | C3H9As | |
| Identificadores | ||
| Número CAS | 593-88-4[1] | |
| ChEBI | 27130 | |
| ChemSpider | 62200 | |
| PubChem | 68978 | |
| UNII | MQ83UQ8A1Q | |
| KEGG | C22417 | |
| SMILES [As](C)(C)C | ||
| InChI InChI=1S/C3H9As/c1-4(2)3/h1-3H3 Key: HTDIUWINAKAPER-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1124 kg/m³; 1,124 g/cm³ | |
| Masa molar | 120,027 g/mol | |
| Punto de fusión | −87,3 °C (186 K) | |
| Punto de ebullición | 52 °C (325 K) | |
| Peligrosidad | ||
| SGA |     | |
| Punto de inflamabilidad | 37,8 K (−235 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
[editar datos en Wikidata] | ||
La trimetilarsina (abreviada como TMA) es un compuesto químico con la fórmula (CH3)3As, comúnmente abreviada como AsMe3. Este derivado orgánico de la arsina se ha utilizado como fuente de arsénico en la industria de la microelectrónica,[2] como componente básico de otros compuestos organoarsénicos y sirve como ligando en la química de coordinación. Tiene un olor característico parecido al del "ajo" y se descubrió en 1854.
Estructura, propiedades y síntesis
La trimetilarsina es un líquido volátil e incoloro, soluble en benceno y otros disolventes orgánicos ligeramente polares, un poco más denso que el agua e insoluble en ella. La molécula de AsMe3 tiene una estructura piramidal, cuyas distancias de enlace As-C tienen una longitud promedio de 1,519 Å y los ángulos C-As-C son de 91,83°, valor compatible con el uso de orbitales p casi puros por parte del átomo de As.[3] El bajo valor de este ángulo de enlace, incluso menor que en la trimetilfosfina PMe3 (98,6°), indica que la hibridación de los orbitales atómicos s y p del As en esta molécula es pobre o inexistente; como resultado, el par solitario permanece en el orbital s subyacente, en lugar de apuntar hacia afuera como en el caso del par solitario en el orbital híbrido sp3 de la molécula de amoníaco. La molécula tiene una cierta polaridad, μ = 0,86 D, un poco menos que la de la trimetilfosfina (1,19 D), una molécula isoelectrónica de valencia con ella.
La trimetilarsina se puede preparar mediante el tratamiento del trióxido de arsénico con trimetilaluminio:[4]
- As2O3 + 1.5 [AlMe3]2 → 2 AsMe3 + 3/n (MeAl-O)n
Existencia y reactividad
La trimetilarsina es un subproducto volátil de la acción microbiana sobre las formas inorgánicas de arsénico que se encuentran de forma natural en rocas y suelos en cantidades de partes por millón.[5] La trimetilarsina se ha detectado solo a niveles de traza (partes por mil millones) en gases de vertedero de Alemania, Canadá y Estados Unidos, y es el principal compuesto que contiene arsénico en dicho gas.[6][7][8]
La trimetilarsina es pirofórica debido a la naturaleza exotérmica de la siguiente reacción, que inicia la combustión:
- AsMe3 + 1/2 O2 → OAsMe3 (TMAO)
Historia
A finales del siglo XIX, el médico y microbiólogo italiano Bartolomeo Gosio (1863-1944) sospechaba que los pigmentos de arsénico utilizados entonces en algunos tipos de pinturas y papeles pintados estaban provocando la muerte inexplicable de un gran número de niños. Descubrió que, en presencia de humedad, el hongo Scopulariopsis brevicaulis (actualmente denominado Microascus brevicaulis) producía un gas tóxico, reconocible por su olor a ajo, cuando actuaba sobre los colorantes de arsénico y, en particular, sobre el verde de París y el verde de Scheele utilizados en los papeles pintados. En 1892 publicó un resumen de sus resultados;[9] el gas tóxico se denominó más tarde "gas de Gosio".
En 1933 el componente tóxico fue identificado como trimetilarsina por el químico Frederick Challenger,[10][11] y en 1971 se demostró que la metilación del arsénico era de origen bacteriano.[12][13] Sin embargo, estudios más recientes muestran que la trimetilarsina tiene una baja toxicidad, lo que sugiere que aún no se conoce con certeza la causa de las muertes y los problemas de salud observados en el siglo XIX.[14]
Referncias
- ↑ Número CAS
- ↑ Hoshino, Masataka (1991). «A mass spectrometric study of the decomposition of trimethylarsine (TMAs) with triethylgallium (TEGa)». Journal of Crystal Growth 110 (4): 704-712. Bibcode:1991JCrGr.110..704H. doi:10.1016/0022-0248(91)90627-H.
- ↑ Wells, A.F. (1984). Structural Inorganic Chemistry, fifth edition. Oxford University Press. ISBN 978-0-19-855370-0.
- ↑ V. V. Gavrilenko, L. A. Chekulaeva, and I. V. Pisareva, "Highly efficient synthesis of trimethylarsine" Izvestiya Akademii Nauk. Seriya Khimicheskaya, No. 8, pp. 2122–2123, 1996.
- ↑ Cullen, W.R., Reimer, K.J. (1989). «Arsenic speciation in the environment». Chem. Rev. 89 (4): 713-764. doi:10.1021/cr00094a002. hdl:10214/2162.
- ↑ Feldmann, J., Cullen, W.R. (1997). «Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the». Environ. Sci. Technol. 31 (7): 2125-2129. doi:10.1021/es960952y.
- ↑ Pinel-Raffaitin, P., LeHecho, I., Amouroux, D., Potin-Gautier, M. (2007). «Distribution and Fate of Inorganic and Organic Arsenic Species in Landfill Leachates and Biogases». Environ. Sci. Technol. 41 (13): 4536-4541. Bibcode:2007EnST...41.4536P. PMID 17695893. doi:10.1021/es0628506.
- ↑ Khoury, J.T. (April 7, 2008). «Analysis of Volatile Arsenic Compounds in Landfill Gas». Odors & Air Emissions 2008. Phoenix, Arizona: Water Environment Federation.
- ↑ B. Gosio (1982). «Action of microphytes on solid compounds of arsenic: a recapitulation». Science 19 (472): 104-106.
- ↑ Frederick Challenger (1955). «Biological methylation». Q. Rev. Chem. Soc. 9 (3): 255-286. doi:10.1039/QR9550900255.
- ↑ Frederick Challenger; Constance Higginbottom; Louis Ellis (1933). «The formation of organo-metalloidal compounds by microorganisms. Part I. Trimethylarsine and dimethylethylarsine». J. Chem. Soc.: 95-101. doi:10.1039/JR9330000095.
- ↑ Ronald Bentley; Thomas G. Chasteen (2002). «Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth». Microbiology and Molecular Biology Reviews 66 (2): 250-271. PMC 120786. PMID 12040126. doi:10.1128/MMBR.66.2.250-271.2002.
- ↑ B. C. McBride; R. S. Wolfe (1971). «Biosynthesis of dimethylarsine by a methanobacterium». Biochemistry 10: 4312-4317.
- ↑ W. R. Cullen; R. Bentley (2005). «The toxicity of trimethylarsine: an urban myth». J. Environ. Monit. 7 (1): 11-15. doi:10.1039/b413752n.








