Chlorure de chloropentaamminecobalt
| Chlorure de chloropentaamminecobalt(III) | |
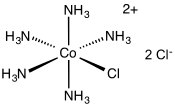 | |
| Structure du chlorure de chloropentaamminecobalt(III) | |
| Identification | |
|---|---|
| No CAS | 13859-51-3 |
| No ECHA | 100.034.163 |
| No CE | 237-594-8 |
| PubChem | 159702 |
| SMILES | N.N.N.N.N.[Cl-].[Cl-].[Cl-].[Co+3] PubChem, vue 3D |
| InChI | Std. InChI : vue 3D InChI=1S/3ClH.Co.5H3N/h3*1H;;5*1H3/q;;;+3;;;;;/p-3 Std. InChIKey : NSYALVBBDKTCLE-UHFFFAOYSA-K |
| Apparence | solide pourpre[1] |
| Propriétés chimiques | |
| Formule | H15Cl3CoN5 |
| Masse molaire[2] | 250,445 ± 0,008 g/mol H 6,04 %, Cl 42,47 %, Co 23,53 %, N 27,96 %, |
| Propriétés physiques | |
| Masse volumique | 1,819 g/cm3[3] à 20 °C |
| Précautions | |
| SGH[3] | |
 Danger H317 : Peut provoquer une allergie cutanée H351 : Susceptible de provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger) P201 : Se procurer les instructions avant utilisation. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P302+P352 : En cas de contact avec la peau : laver abondamment à l’eau et au savon. P308+P313 : En cas d’exposition prouvée ou suspectée : consulter un médecin. | |
| NFPA 704[3] | |
1 2 0 | |
| Classification du CIRC | |
| Groupe 2B du CIRC : cancérogène possible[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le chlorure de chloropentaamminecobalt(III) est un composé chimique de formule chimique [Co(NH3)5Cl]Cl2. C'est un sel rouge-violet, diamagnétique, soluble dans l'eau, du cation [Co(NH3)5Cl]2+ d'une part et de deux anions chlorure Cl− d'autre part. Le cation est lui-même un complexe ammine de cobalt à l'état d'oxydation +3. Il présente un intérêt académique et historique.
-
![Poudre de [Co(NH3)5Cl]Cl2.](//upload.wikimedia.org/wikipedia/commons/thumb/3/39/CoA5ClCl2.jpg/360px-CoA5ClCl2.jpg) Poudre de [Co(NH3)5Cl]Cl2.
Poudre de [Co(NH3)5Cl]Cl2.
Synthèse et réactions
Sa synthèse commence par l'oxydation d'une solution de chlorure de cobalt(II) CoCl2 et d'ammoniaque NH3[4],[5] :
- 2 CoCl2·6H2O + 10 NH3 + 2 HCl + H2O2 ⟶ 2 [Co(NH3)5(OH2)]Cl3 + 12 H2O.
Cet intermédiaire est ensuite chauffé pour induire la coordination de l'un des ligands chlorure de la sphère externe :
- [Co(NH3)5(OH2)]Cl3 ⟶ [Co(NH3)5Cl]Cl2 + H2O.
Le dication [Co(NH3)5Cl]2+ a une symétrie C4v[6],[7].
En solution aqueuse, le chlorure de chloropentaamminecobalt(III) reforme le complexe aquapentaammine [Co(NH3)5(OH2)]Cl3. Avec l'acide sulfurique concentré, le chlorure de chloropentaamminecobalt(III) forme le complexe d'hydrogénosulfate [Co(NH3)5OSO3H]2+.
Histoire
Les complexes de cobalt tiennent depuis longtemps une place importante en chimie inorganique, étant nombreux, colorés et faciles à préparer. C'est en partie sur la base de son étude de la chimie de coordination du cobalt qu'Alfred Werner a reçu le prix Nobel de chimie. Avant Werner, les modèles d'ammines postulaient des chaînes de centres azote pentavalents. Ce modèle de Jørgensen-Bloomstrand a été invalidé par Werner qui introduisit l'idée que les complexes de coordination comportent des atomes métalliques de géométrie octaédriques et tétraédriques, avec de l'ammoniac et d'autres ligands liés individuellement au métal. Le modèle de Werner expliquait pourquoi les ligands de la sphère interne sont moins réactifs[8]. Dans le complexe [Co(NH3)5Cl]Cl2, deux ions chlorure sont dans la sphère externe comme contre-ions et le troisième est coordonné au centre Co(III) dans la sphère interne : une réaction avec un excès de nitrate d'argent AgNO3 précipiterait immédiatement les deux contre-ions chlorure, mais pas le ligand chlorure lié au cobalt.
Notes et références
- ↑ a et b Fiche Sigma-Aldrich du composé Pentaamminechlorocobalt(III) chloride 98%, consultée le 9 août 2022., PDF
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b et c « Fiche du composé Chloropentaamminecobalt(III) chloride », sur Alfa Aesar (consulté le ).
- ↑ (en) Gert G. Schlessinger, Doyle Britton, Thornton Rhodes et Elizabeth Ng, « Chloropentaamminecobalt(III) Chloride », Inorganic Syntheses, vol. 9, , p. 160 (DOI 10.1002/9780470132401.ch43, lire en ligne).
- ↑ (en) Gregory M. Williams, John Olmstead et Andrew P. Breksa, « Coordination complexes of cobalt: Inorganic synthesis in the general chemistry laboratory », Journal of Chemical Education, vol. 66, no 12, , p. 1043 (DOI 10.1021/ed066p1043, Bibcode 1989JChEd..66.1043W, lire en ligne).
- ↑ (en) G. G. Messmer et E. L. Amma, « Redetermination of the crystal structure of chloropentamminecobalt(III) dichloride », Acta Crystallographica Section B, vol. 24, , p. 417-422 (DOI 10.1107/S0567740868002475, lire en ligne).
- ↑ (en) Trevor W. Hambley et Peter A. Lay, « Comparisons of π-bonding and hydrogen bonding in isomorphous compounds: [M(NH3)5Cl]Cl2 (M = Cr, Co, Rh, Ir, Ru, Os) », Inorganic Chemistry, vol. 25, no 25, , p. 4553-4558 (DOI 10.1021/ic00245a020, lire en ligne).
- ↑ (en) Ekkehard Schwab, « Cobalt », Chemical & Engineering News, vol. 81, no 36, , p. 80 (DOI 10.1021/cen-v081n036.p080, lire en ligne).
 Portail de la chimie
Portail de la chimie

![Poudre de [Co(NH3)5Cl]Cl2.](http://upload.wikimedia.org/wikipedia/commons/thumb/3/39/CoA5ClCl2.jpg/360px-CoA5ClCl2.jpg)










