1,3-双極子
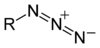   |
| 上から アジド、ニトロン、ニトロ化合物 |
1,3-双極子(いちさんそうきょくし、英: 1,3-dipole)は、
という形式の共鳴混成体で表される構造を持ち、電気的に中性な化合物のことである[1][2]。右の構造式のように1位(原子X)が正電荷、3位(原子Z)が負電荷を帯びた共鳴構造の寄与があるため1,3-双極子と呼ばれる。
具体的には以下のような化合物が挙げられる。

| 名称 | 構造 |
|---|---|
| アジド | |
| ニトロ化合物 | |
| ジアゾ化合物 | |
| オゾン | |
| 酸化物 | |
| アゾキシド化合物 | |
| カルボニルオキシド(クリーゲー双性イオン)[3][4] | |
| ニトリルオキシド | |
| 亜酸化窒素 | |
| ニトロン | |
| イミン誘導体 | |
| アゾメチンイミン | |
| ニトリルイミン(英語版) | |
| カルボニルイミン | |
| イリド | |
| アゾメチンイリド | |
| ニトリルイリド | |
| カルボニルイリド | |
1,3-双極子付加反応
1,3-双極子は二重結合に対して原子 X と原子 Z を反応点とした付加反応を行い、5員環の環状化合物を生成する。これを 1,3-双極子付加反応 (1,3-dipolar addition) という。ヘテロ5員環化合物を合成するのに重要な反応である。
この反応は [4π+2π]-環化付加反応の一種であり、協奏的に2つの結合が生成する。そのため、同じ [4π+2π]-環化付加反応の一種であるディールス・アルダー反応と同様にシス型の立体特異性を示す。反応相手の二重結合を持つ化合物を、ディールス・アルダー反応のジエノフィル(親ジエン体)にならってダイポーラロフィル(dipolarophile、親双極子)という。
付加の方向の位置選択性はフロンティア軌道理論によって説明される通り、1,3-双極子とダイポーラロフィルのフロンティア軌道の密度が最大となる位置同士で結合が生成する。ディールス・アルダー反応では通常はジエンの最高被占軌道 (HOMO) とジエノフィルの最低空軌道 (LUMO) とが相互作用するのに対し、1,3-双極子付加反応では決まっておらず 1,3-双極子とダイポーラロフィルの組み合わせによって異なる。エネルギー差の小さい方の HOMO-LUMO の組み合わせで相互作用が起こり、それによって位置選択性が決定される。
脚注
- ^ Francis A. Carey, Richard J. Sundberg (2007). “Part A: Structure and mechanisms”. Advanced Organic Chemistry (5, illustrated ed.). Springer. p. 874. ISBN 9780387448978
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "dipolar compounds".
- ^ “Ozonolysis mechanism”. Organic Chemistry Portal. 2012年1月29日閲覧。
- ^ Li, Jie Jack (2006). “Criegee mechanism of ozonolysis”. Name Reactions. pp. 173-174. doi:10.1007/3-540-30031-7_77. http://www.springerlink.com/content/p723n6134737nh33/















