Lipopeptydy
Lipopeptydy – organiczne związki chemiczne składające się z części peptydowej i lipidowej. Wiele z naturalnych i syntetycznych lipopeptydów wykazuje aktywność biologiczną[1]. Naturalne lipopeptydy są syntezowane drogą nierybosomalną w komórkach bakterii oraz grzybów, w trakcie przemian różnych związków organicznych[2].
Budowa
Cząsteczki lipopeptydów zbudowane są z cyklicznej lub liniowej części peptydowej oraz kowalencyjnie przyłączonego do niej łańcucha lipidowego lub innej cząsteczki lipofilowej. Ze względu na swoją budowę mają właściwości amfifilowe, to znaczy, że zawierają ugrupowania hydrofobowe – część lipidową, jak i hydrofilowe – część peptydową. Cyklizacja części peptydowej lipopeptydów znacznie wpływa na ochronę przez proteolizą[1].
Zastosowanie
Antybiotyki lipopeptydowe
Wiele lipopeptydów to antybiotyki należące do klasy peptydów przeciwdrobnoustrojowych o szerokim spektrum działania przeciwbakteryjnego[2]. Pierwszy lipopeptyd o właściwościach przeciwdrobnoustrojowych, czyli polimyksyna A został odkryty i wyizolowany w 1949 r. z bakterii glebowej Bacillus polymyxa[3]. Mechanizm działania lipopetydów opiera się na dezintegracji błony komórkowej drobnoustrojów, co prowadzi do powstania defektów w jej strukturze, a w efekcie do utraty potencjału błonowego oraz redukcji zdolności syntezy ATP, co w konsekwencji prowadzi do śmierci komórki[2].
Daptomycyna jest powszechnie stosowanym, naturalnie występującym, cyklicznym lipopeptydem. Jest stosowana jako lek w Stanach Zjednoczonych w leczeniu ogólnoustrojowych i zagrażających życiu zakażeń wywołanych przez bakterie Gram-dodatnie. Wykazuje aktywność przeciwko klinicznie opornym patogenom, takim jak gronkowiec złocisty oporny na metycylinę (MRSA), enterokoki oporne na wankomycynę (VRE), średniowrażliwe na glikopeptydy S. aureus (GISA), koagulazo-ujemne gronkowce (CNS) i oporny na penicylinę Streptococcus pneumoniae (PRSP)[4][5].
Inną grupą antybiotyków lipopeptydowych są polimyksyny B i E[6]. Pozwalają one zwalczać antybiotykooporne bakterie Gram-ujemne[7], a ich działanie polega na uwrażliwieniu bakterii na działanie antybiotyków skutecznych przeciw bakteriom Gram-dodatnim, gdyż umożliwiają ich przeniknięcie przez błonę komórkową[6]. Ich wadą jest neuro- i nefrotoksyczność[7].
Oktapeptyny są uważane za kolejną obiecującą grupę lipopeptydów przeciwbakteryjnych. Zostały opracowane w latach 70. XX wieku. Wykazują dobrą aktywność przeciwko bakteriom Gram-dodatnim, drożdżom i grzybom, mają lepsze działanie przeciwdrobnoustrojowe przeciwko opornym na polimyksynę bakteriom Gram-ujemnym, a potencjalnie oktapeptyna C4 ma zmniejszoną nefrotoksyczność w porównaniu z polimyksyną B i E. Wadą jest to, że jej skuteczność in vivo jest raczej słaba, najprawdopodobniej z powodu dużego wiązania z białkami osocza. Innym członkiem tej grupy jest oktapeptyna B5, która wykazuje działanie bakteriobójcze na bakterie Gram-ujemne, w tym wielolekooporne i skrajnie lekooporne izolaty kliniczne[8][9].
Echinokandyny stanowią klasę lipopeptydów o właściwościach przeciwgrzybiczych, są inhibitorami syntezy enzymu β(1,3)-D-glukanu[3]. Wszystkie cząsteczki w zastosowaniu klinicznym oraz na etapie badań rozwojowych to amfifilowe cykliczne heksapeptydy z N-połączonym łańcuchem bocznym acylolipidu i masą cząsteczkową około 1200 Da[10]. Echinokandyny zostały wyizolowane po raz pierwszy ze szczepu Aspergillus ruglosus i Aspergillus nidulans i charakteryzują się silnym działaniem przeciwgrzybiczym i przeciwdrożdżowym[11].
Pierwszym zarejestrowanym lekiem z grupy echinokandyn była półsyntetyczna kaspofungina, która pozyskiwana jest z grzyba Glarea lozoyensis. Jest przeznaczona do leczenia inwazyjnej aspergilozy[12].
-
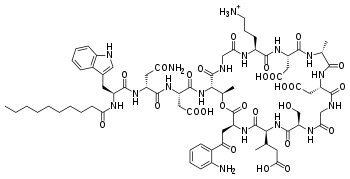 Daptomycyna
Daptomycyna -
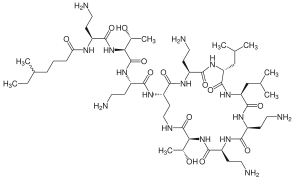 Polimyksyna E
Polimyksyna E -
 Echinokandyna B
Echinokandyna B -
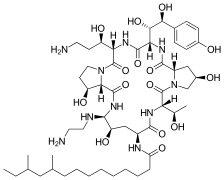 Kaspofungina
Kaspofungina
Prace rozwojowe
Ze względu na stale rosnącą antybiotykooporność bakterii poszukiwane są nowe, często syntetyczne, lipopeptydy. Jednym z przykładów są związki zbudowane z tetrapeptydu sprzężonego z kwasami tłuszczowymi o różnych długościach łańcucha. Wpływają one na modelowe błony komórek bakteryjnych, zarówno bakterii Gram-ujemnych, jak i Gram-dodatnich, oraz wykazują stosunkowo niski poziom aktywności hemolitycznej[5].
Lipopeptydy w przemyśle kosmetycznym
Lipopeptydy są stosowane w przemyśle kosmetycznym ze względy na swoje wyjątkowe właściwości powierzchniowe (obniżają napięcie międzyfazowe, w szczególności napięcie powierzchniowe wody), działają przeciwzmarszczkowo oraz nawilżająco na skórę[13].
Surfaktyna jest najbardziej aktywnym biosurfaktantem o doskonałych właściwościach[14]. Znajduje zastosowanie dermatologiczne – stosuje się ją miejscowo. Surfaktyny są wysoce biokompatybilne i bardzo mało cytotoksyczne dla komórek ssaków. Niektóre firmy wykorzystują ją także w kosmetykach myjących[13][15].
Kilka firm z siedzibą w USA wprowadziło na rynek produkty anti-aging zawierające lipopeptydy. Właściwości lipopeptydów bezpośrednio pomagają stymulować produkcję kolagenu i elastyny. Dodatek antyoksydantu w kosmetykach to najskuteczniejszy sposób na opóźnienie peroksydacji lipidów[16]. Przeciwutleniacze chronią skórę przed wolnymi rodnikami, a co za tym idzie, sprawiają, że skóra jest gładsza i bardziej miękka. Dodatkowo dzięki swoim właściwościom przeciwbakteryjnym zabezpieczają skórę przed rozwojem bakterii, co przekłada się na bezpieczeństwo produktów kosmetycznych[17].
Lipopeptydy w przemyśle spożywczym
W przemyśle spożywczym lipopeptydy są wykorzystywane jako emulgatory w przetwarzaniu surowej żywności[3].
W piekarnictwie surfaktyny i ramnolipidy służą do zapewnienia trwałości, struktury i objętości wypieków. W przypadku wypieku muffinów i croissantów zaleca się dodatek 0,10% ramnolipidu w celu poprawy zawartości wilgoci, konsystencji i zachowania świeżości przez dłuższy czas[18]. Lipopeptydy zapobiegają również korozji powierzchni ze stali nierdzewnej[19].
Przypisy
- ↑ a b Ian W.I.W. Hamley Ian W.I.W., Lipopeptides: from self-assembly to bioactivity, „Chemical Communications”, 51 (41), 2015, s. 8574–8583, DOI: 10.1039/c5cc01535a, PMID: 25797909 (ang.).
- ↑ a b c PaulinaP. Czechowicz PaulinaP., JoannaJ. Nowicka JoannaJ., Antimicrobial activity of lipopeptides, „Postępy Mikrobiologii – Advancements of Microbiology”, 57 (3), 2018, s. 213–227, DOI: 10.21307/PM-2018.57.3.213 (ang.).
- ↑ a b c Santi M.S.M. Mandal Santi M.S.M., Aulus E.A.D.A.E.A.D. Barbosa Aulus E.A.D.A.E.A.D., Octavio L.O.L. Franco Octavio L.O.L., Lipopeptides in microbial infection control: scope and reality for industry, „Biotechnology Advances”, 31 (2), 2013, s. 338–345, DOI: 10.1016/j.biotechadv.2013.01.004, PMID: 23318669 (ang.).
- ↑ F.P.F.P. Tally F.P.F.P. i inni, Daptomycin: a novel agent for Gram-positive infections, „Expert Opinion on Investigational Drugs”, 8 (8), 1999, s. 1223–1238, DOI: 10.1517/13543784.8.8.1223, PMID: 15992147 (ang.).
- ↑ a b JoannaJ. Juhaniewicz-Dębińska JoannaJ., DamianD. Dziubak DamianD., SławomirS. Sęk SławomirS., Physicochemical Characterization of Daptomycin Interaction with Negatively Charged Lipid Membranes, „Langmuir”, 36 (19), 2020, s. 5324–5335, DOI: 10.1021/acs.langmuir.0c00716, PMID: 32340456, PMCID: PMC7588137 (ang.).
- ↑ a b MarttiM. Vaara MarttiM., Polymyxins and Their Potential Next Generation as Therapeutic Antibiotics, „Frontiers in Microbiology”, 10, 2019, DOI: 10.3389/fmicb.2019.01689 (ang.).
- ↑ a b Nagah E.N.E. Edrees Nagah E.N.E. i inni, Curcumin alleviates colistin-induced nephrotoxicity and neurotoxicity in rats via attenuation of oxidative stress, inflammation and apoptosis, „Chemico-Biological Interactions”, 294, 2018, s. 56–64, DOI: 10.1016/j.cbi.2018.08.012, PMID: 30138604 (ang.).
- ↑ TonyT. Velkov TonyT. i inni, Structure, Function, and Biosynthetic Origin of Octapeptin Antibiotics Active against Extensively Drug-Resistant Gram-Negative Bacteria, „Cell Chemical Biology”, 25 (4), 2018, 380–391.e5, DOI: 10.1016/j.chembiol.2018.01.005, PMID: 29396290, PMCID: PMC6560181 (ang.).
- ↑ Gayan Heruka DeG.H.D. Zoysa Gayan Heruka DeG.H.D. i inni, Antimicrobial peptides with potential for biofilm eradication: synthesis and structure activity relationship studies of battacin peptides, „Journal of Medicinal Chemistry”, 58 (2), s. 625–639, DOI: 10.1021/jm501084q, PMID: 25495219 (ang.).
- ↑ David W.D.W. Denning David W.D.W., Echinocandin antifungal drugs, „The Lancet”, 362 (9390), 2003, s. 1142–1151, DOI: 10.1016/S0140-6736(03)14472-8 (ang.).
- ↑ GiovannaG. Pirri GiovannaG. i inni, Lipopeptides as anti-infectives: a practical perspective, „Open Life Sciences”, 4 (3), 2009, s. 258–273, DOI: 10.2478/s11535-009-0031-3 (ang.).
- ↑ ValérieV. Letscher-Bru ValérieV., RaoulR. Herbrecht RaoulR., Caspofungin: the first representative of a new antifungal class, „The Journal of Antimicrobial Chemotherapy”, 51 (3), 2003, s. 513–521, DOI: 10.1093/jac/dkg117, PMID: 12615851 (ang.).
- ↑ a b M.M. Kanlayavattanakul M.M., N.N. Lourith N.N., Lipopeptides in cosmetics, „International Journal of Cosmetic Science”, 32 (1), 2010, s. 1–8, DOI: 10.1111/j.1468-2494.2009.00543.x, PMID: 19889045 (ang.).
- ↑ E.E. Rosenberg E.E., E.Z.E.Z. Ron E.Z.E.Z., High- and low-molecular-mass microbial surfactants, „Applied Microbiology and Biotechnology”, 52 (2), 1999, s. 154–162, DOI: 10.1007/s002530051502, PMID: 10499255 (ang.).
- ↑ K.K. Arima K.K., A.A. Kakinuma A.A., G.G. Tamura G.G., Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation, „Biochemical and Biophysical Research Communications”, 31 (3), 1968, s. 488–494, DOI: 10.1016/0006-291x(68)90503-2, PMID: 4968234 (ang.).
- ↑ PoojaP. Singh PoojaP., Swaranjit SinghS.S. Cameotra Swaranjit SinghS.S., Potential applications of microbial surfactants in biomedical sciences, „Trends in Biotechnology”, 22 (3), 2004, s. 142–146, DOI: 10.1016/j.tibtech.2004.01.010, PMID: 15036865 (ang.).
- ↑ LijunL. Sun LijunL. i inni, Isolation and characterization of a co-producer of fengycinsand surfactins, endophytic Bacillus amyloliquefaciens ES-2, from Scutellaria baicalensis Georgi, „World Journal of Microbiology and Biotechnology”, 22 (12), 2006, s. 1259–1266, DOI: 10.1007/s11274-006-9170-0 (ang.).
- ↑ Niranjan R.N.R. Gandhi Niranjan R.N.R., Victoria L. PalmerV.L.P. Skebba Victoria L. PalmerV.L.P., Rhamnolipid compositions and related methods of use, patent US 7968499B2, 28 czerwca 2011 (ang.).
- ↑ CatherineC. Dagbert CatherineC., ThierryT. Meylheuc ThierryT., Marie-NoëlleM.N. Bellon-Fontaine Marie-NoëlleM.N., Corrosion behaviour of AISI 304 stainless steel in presence of a biosurfactant produced by Pseudomonas fluorescens, „Electrochimica Acta”, 51 (24), 2006, s. 5221–5227, DOI: 10.1016/j.electacta.2006.03.063 (ang.).












