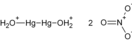Нитрат ртути(I)
| Нитрат ртути(I) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Нитрат ртути(I) | ||
| Хим. формула | Hg2(NO3)2 | ||
| Физические свойства | |||
| Состояние | бесцветные кристаллы | ||
| Молярная масса | 525.2 г/моль | ||
| Плотность | 4,79 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 70 °C | ||
| Энтальпия | |||
| • образования | -868 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | [7782-86-7] | ||
| PubChem | 51346573 и 11318980 | ||
| Рег. номер EINECS | 233-886-4 | ||
| SMILES | [N+](=O)([O-])O[Hg].[N+](=O)([O-])O[Hg].O.O | ||
| InChI | InChI=1S/2Hg.2NO3.2H2O/c;;2*2-1(3)4;;/h;;;;2*1H2/q2*+1;2*-1;; LSABZDVKJBWCBE-UHFFFAOYSA-N | ||
| ChemSpider | 9493944 и 21493988 | ||
| Безопасность | |||
| Токсичность | Чрезвычайно токсичен | ||
| NFPA 704 |  1 3 1 OX | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Нитрат ртути(I) — химическое соединение, существует только в виде димера .
Синонимы: динитрат диртути, ртуть азотнокислая закисная.
Физические и химические свойства

В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2•2H2O. На воздухе теряет кристаллогидратную воду.
Неустойчив, при добавлении щелочи к раствору соли образуется чёрный осадок:
Разлагается при температуре 70-150°C:
Концентрированный раствор соли гидролизуется водой с образованием осадка основной соли:
Реагирует с разбавленной хлороводородной кислотой:
Окисляется горячей концентрированной азотной кислотой:
Может также окислиться разбавленной азотной кислотой в присутствии кислорода:
Выпадение желтого осадка ртути при реакции с медью:
Реагирует с насыщенным раствором сероводорода:
Выпадает осадок дииодида диртути при добавлении иодида калия:
На холоде реагирует с гидрокарбонатом калия:
Получение
Соль может быть получена из металлической ртути при действии разбавленной азотной кислоты на холоде:
А также при добавлении жидкой ртути к нитрату ртути:
Производство
В СССР выпускался химический реактив Ртуть(I) азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Токсикология и физиологические свойства
Как и многие другие соединения ртути, нитрат ртути(I) Hg2(NO3)2 (ртуть азотнокислая, закисная; динитрат диртути, нитрат диртути(2+)) - это очень токсичное вещество. В высоких концентрациях вредно влияет на центральную нервную систему.
Литература
- Химическая энциклопедия: В 5 т. / Н. С. Зефиров (гл. ред.) и др. — М.: Большая Российская энцикл, 1995. — Т. 4. — С. 279. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — М.: Химия, 1996. — С. 309-311. — 479 с. — 5000 экз. — ISBN 5-7245-0948-2.
Ссылки
- Термодинамические свойства водного раствора нитрата ртути(I)